Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
| Atom helium | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Ilustrasi atom helium yang memperlihatkan inti atomawan elektron (hitam). Inti atom (kanan atas) berbentuk simetris bulat, walaupun untuk inti atom yang lebih rumit ia tidaklah selalu demikian. (merah muda) dan distribusi | ||||||||
| Klasifikasi | ||||||||
| ||||||||
| Sifat-sifat | ||||||||
|
| Portal Kimia |
Atom adalah suatu satuan dasar materi, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang mengelilinginya. Inti atom terdiri atas proton yang bermuatan positif, dan neutron yang bermuatan netral (kecuali pada inti atom Hidrogen-1, yang tidak memiliki neutron). Elektron-elektron pada sebuah atom terikat pada inti atom oleh gaya elektromagnetik. Sekumpulan atom demikian pula dapat berikatan satu sama lainnya, dan membentuk sebuah molekul. Atom yang mengandung jumlah proton dan elektron yang sama bersifat netral, sedangkan yang mengandung jumlah proton dan elektron yang berbeda bersifat positif atau negatif dan disebut sebagai ion. Atom dikelompokkan berdasarkan jumlah proton dan neutron yang terdapat pada inti atom tersebut. Jumlah proton pada atom menentukan unsur kimia atom tersebut, dan jumlah neutron menentukan isotop unsur tersebut.
Istilah atom berasal dari Bahasa YunaniIndia dan Yunani. Pada abad ke-17 dan ke-18, para kimiawan meletakkan dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat tertentu tidak dapat dibagi-bagi lebih jauh lagi menggunakan metode-metode kimia. Selama akhir abad ke-19 dan awal abad ke-20, para fisikawan berhasil menemukan struktur dan komponen-komponen subatom di dalam atom, membuktikan bahwa 'atom' tidaklah tak dapat dibagi-bagi lagi. Prinsip-prinsip mekanika kuantum[1] yang digunakan para fisikawan kemudian berhasil memodelkan atom. (ἄτομος/átomos, α-τεμνω), yang berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat dibagi-bagi lagi. Konsep atom sebagai komponen yang tak dapat dibagi-bagi lagi pertama kali diajukan oleh para filsuf
Dalam pengamatan sehari-hari, secara relatif atom dianggap sebuah objek yang sangat kecil yang memiliki massa yang secara proporsional kecil pula. Atom hanya dapat dipantau dengan menggunakan peralatan khusus seperti mikroskop gaya atom. Lebih dari 99,9% massa atom berpusat pada inti atom,[catatan 1]peluruhan radioaktif. Hal ini dapat mengakibatkan transmutasi, yang mengubah jumlah proton dan neutron pada inti.[2] Elektron yang terikat pada atom mengandung sejumlah aras energi, ataupun orbital, yang stabil dan dapat mengalami transisi di antara aras tersebut dengan menyerap ataupun memancarkan foton yang sesuai dengan perbedaan energi antara aras. Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur, dan mempengaruhi sifat-sifat magnetis atom tersebut. dengan proton dan neutron yang bermassa hampir sama. Setiap unsur paling tidak memiliki satu isotop dengan inti yang tidak stabil, yang dapat mengalami
Sejarah
Konsep bahwa materi terdiri dari satuan-satuan terpisah yang tidak dapat dibagi lagi menjadi satuan yang lebih kecil telah ada selama satu milenium. Namun, pemikiran tersebut masihlah bersifat abstrak dan filosofis, daripada berdasarkan pengamatan empiris dan eksperimen. Secara filosofis, deskripsi sifat-sifat atom bervariasi tergantung pada budaya dan aliran filosofi tersebut, dan seringkali pula mengandung unsur-unsur spiritual di dalamnya. Walaupun demikian, pemikiran dasar mengenai atom dapat diterima oleh para ilmuwan ribuan tahun kemudian, karena ia secara elegan dapat menjelaskan penemuan-penemuan baru pada bidang kimia.[3]
Rujukan paling awal mengenai konsep atom dapat ditilik kembali kepada zaman India kuno pada tahun 800 sebelum masehi,[4] yang dijelaskan dalam naskah filsafat Jainisme sebagai anu dan paramanu.[4][5] Aliran mazhab Nyaya dan Vaisesika mengembangkan teori yang menjelaskan bagaimana atom-atom bergabung menjadi benda-benda yang lebih kompleks.[6] Satu abad kemudian muncul rujukan mengenai atom di dunia Barat oleh Leukippos, yang kemudian oleh muridnya Demokritos pandangan tersebut disistematiskan. Kira-kira pada tahun 450 SM, Demokritos menciptakan istilah átomos (bahasa Yunani: ἄτομος), yang berarti "tidak dapat dipotong" ataupun "tidak dapat dibagi-bagi lagi". Teori Demokritos mengenai atom bukanlah usaha untuk menjabarkan suatu fenomena fisis secara rinci, melainkan suatu filosofi yang mencoba untuk memberikan jawaban atas perubahan-perubahan yang terjadi pada alam.[1] Filosofi serupa juga terjadi di India, namun demikian ilmu pengetahuan modern memutuskan untuk menggunakan istilah "atom" yang dicetuskan oleh Demokritos.[3]
Kemajuan lebih jauh pada pemahaman mengenai atom dimulai dengan berkembangnya ilmu kimia. Pada tahun 1661, Robert Boyle mempublikasikan buku The Sceptical Chymist yang berargumen bahwa materi-materi di dunia ini terdiri dari berbagai kombinasi "corpuscules", yaitu atom-atom yang berbeda. Hal ini berbeda dengan pandangan klasik yang berpendapat bahwa materi terdiri dari unsur-unsur udara, tanah, api, dan air.[7]element (unsur) didefinisikan oleh seorang bangsawan dan peneliti Perancis, Antoine Lavoisier, sebagai bahan dasar yang tidak dapat dibagi-bagi lebih jauh lagi dengan menggunakan metode-metode kimia.[8] Pada tahun 1789, istilah

Berbagai atom dan molekul yang digambarkan pada buku John Dalton, A New System of Chemical Philosophy (1808).
Pada tahun 1803, John Dalton menggunakan konsep atom untuk menjelaskan mengapa unsur-unsur selalu bereaksi dalam perbandingan yang bulat dan tetap, serta mengapa gas-gas tertentu lebih larut dalam air dibandingkan dengan gas-gas lainnya. Ia mengajukan pendapat bahwa setiap unsur mengandung atom-atom tunggal unik, dan atom-atom tersebut selanjutnya dapat bergabung untuk membentuk senyawa-senyawa kimia.[9][10]
Teori partikel ini kemudian dikonfirmasikan lebih jauh lagi pada tahun 1827, yaitu ketika botaniwan Robert Brown menggunakan mikroskop untuk mengamati debu-debu yang mengambang di atas air dan menemukan bahwa debu-debu tersebut bergerak secara acak. Fenomena ini kemudian dikenal sebagai "Gerak Brown". Pada tahun 1877, J. Desaulx mengajukan pendapat bahwa fenomena ini disebabkan oleh gerak termal molekul air, dan pada tahun 1905 Albert Einstein membuat analisis matematika terhadap gerak ini.[11][12][13]Jean Perrin kemudian menggunakan hasil kerja Einstein untuk menentukan massa dan dimensi atom secara eksperimen, yang kemudian dengan pasti menjadi verifikasi atas teori atom Dalton.[14] Fisikawan Perancis
Berdasarkan hasil penelitiannya terhadap sinar katoda, pada tahun 1897 J. J. Thomson menemukan elektron dan sifat-sifat subatomiknya. Hal ini meruntuhkan konsep atom sebagai satuan yang tidak dapat dibagi-bagi lagi.[15] Thomson percaya bahwa elektron-elektron terdistribusi secara merata di seluruh atom, dan muatan-muatannya diseimbangkan oleh keberadaan lautan muatan positif (model puding prem).
Namun pada tahun 1909, para peneliti di bawah arahan Ernest Rutherford menembakkan ion helium ke lembaran tipis emas, dan menemukan bahwa sebagian kecil ion tersebut dipantulkan dengan sudut pantulan yang lebih tajam dari yang apa yang diprediksikan oleh teori Thomson. Rutherford kemudian mengajukan pendapat bahwa muatan positif suatu atom dan kebanyakan massanya terkonsentrasi pada inti atom, dengan elektron yang mengitari inti atom seperti planet mengitari matahari. Muatan positif ion helium yang melewati inti padat ini haruslah dipantulkan dengan sudut pantulan yang lebih tajam. Pada tahun 1913, ketika bereksperimen dengan hasil proses peluruhan radioaktif, Frederick Soddy menemukan bahwa terdapat lebih dari satu jenis atom pada setiap posisi tabel periodik.[16] Istilah isotop kemudian diciptakan oleh Margaret Todd sebagai nama yang tepat untuk atom-atom yang berbeda namun merupakan satu unsur yang sama. J.J. Thomson selanjutnya menemukan teknik untuk memisahkan jenis-jenis atom tersebut melalui hasil kerjanya pada gas yang terionisasi.[17]
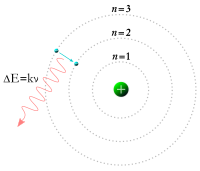
Model atom hidrogen Bohr yang menunjukkan loncatan elektron antara orbit-orbit tetap dan memancarkan energi foton dengan frekuensi tertentu.
Sementara itu, pada tahun 1913 fisikawan Niels Bohr mengkaji ulang model atom Rutherford dan mengajukan pendapat bahwa elektron-elektron terletak pada orbit-orbit yang terkuantisasi serta dapat meloncat dari satu orbit ke orbit lainnya, meskipun demikian tidak dapat dengan bebas berputar spiral ke dalam maupun keluar dalam keadaan transisi.[18] Suatu elektron haruslah menyerap ataupun memancarkan sejumlah energi tertentu untuk dapat melakukan transisi antara orbit-orbit yang tetap ini. Apabila cahaya dari materi yang dipanaskan memancar melalui prisma, ia menghasilkan suatu spektrum multiwarna. Penampakan garis-garis spektrum tertentu ini berhasil dijelaskan oleh teori transisi orbital ini.[19]
Ikatan kimia antar atom kemudian pada tahun 1916 dijelaskan oleh Gilbert Newton Lewis sebagai interaksi antara elektron-elektron atom tersebut.[20] Atas adanya keteraturan sifat-sifat kimiawi dalam tabel periode kimia,[21] kimiawan Amerika Irving Langmuir tahun 1919 berpendapat bahwa hal ini dapat dijelaskan apabila elektron-elektron pada sebuah atom saling berhubungan atau berkumpul dalam bentuk-bentuk tertentu. Sekelompok elektron diperkirakan menduduki satu set kelopak elektron di sekitar inti atom.
Percobaan Stern-Gerlach pada tahun 1922 memberikan bukti lebih jauh mengenai sifat-sifat kuantum atom. Ketika seberkas atom perak ditembakkan melalui medan magnet, berkas tersebut terpisah-pisah sesuai dengan arah momentum sudut atom (spin). Oleh karena arah spin adalah acak, berkas ini diharapkan menyebar menjadi satu garis. Namun pada kenyataannya berkas ini terbagi menjadi dua bagian, tergantung dari apakah spin atom tersebut berorientasi ke atas ataupun ke bawah.[22]
Pada tahun 1926, dengan menggunakan pemikiran Louis de Broglie bahwa partikel berperilaku seperti gelombang, Erwin Schrödinger mengembangkan suatu model atom matematis yang menggambarkan elektron sebagai gelombang tiga dimensi daripada sebagai titik-titik partikel. Konsekuensi penggunaan bentuk gelombang untuk menjelaskan elektron ini adalah bahwa adalah tidak mungkin untuk secara matematis menghitung posisi dan momentum partikel secara bersamaan. Hal ini kemudian dikenal sebagai prinsip ketidakpastian, yang dirumuskan oleh Werner Heisenberg pada 1926. Menurut konsep ini, untuk setiap pengukuran suatu posisi, seseorang hanya bisa mendapatkan kisaran nilai-nilai probabilitas momentum, demikian pula sebaliknya. Walaupun model ini sulit untuk divisualisasikan, ia dapat dengan baik menjelaskan sifat-sifat atom yang terpantau yang sebelumnya tidak dapat dijelaskan oleh teori mana pun. Oleh sebab itu, model atom yang menggambarkan elektron mengitari inti atom seperti planet mengitari matahari digugurkan dan digantikan oleh model orbital atom di sekitar inti di mana elektron paling berkemungkinan berada.[23][24]

Diagram skema spetrometer massa sederhana.
Perkembangan pada spektrometri massa mengijinkan dilakukannya pengukuran massa atom secara tepat. Peralatan spektrometer ini menggunakan magnet untuk membelokkan trayektori berkas ion, dan banyaknya defleksi ditentukan dengan rasio massa atom terhadap muatannya. Kimiawan Francis William Astonkaidah bilangan bulat.[25] Penjelasan pada perbedaan massa isotop ini berhasil dipecahkan setelah ditemukannya neutron, suatu partikel bermuatan netral dengan massa yang hampir sama dengan proton, yaitu oleh James Chadwick pada tahun 1932. Isotop kemudian dijelaskan sebagai unsur dengan jumlah proton yang sama, namun memiliki jumlah neutron yang berbeda dalam inti atom.[26] menggunakan peralatan ini untuk menunjukkan bahwa isotop mempunyai massa yang berbeda. Perbedaan massa antar isotop ini berupa bilangan bulat, dan ia disebut sebagai
Pada tahun 1950-an, perkembangan pemercepat partikel dan detektor partikel mengijinkan para ilmuwan mempelajari dampak-dampak dari atom yang bergerak dengan energi yang tinggi.[27] Neutron dan proton kemudian diketahui sebagai hadron, yaitu komposit partikel-partikel kecil yang disebut sebagai kuark. Model-model standar fisika nuklir kemudian dikembangkan untuk menjelaskan sifat-sifat inti atom dalam hal interaksi partikel subatom ini.[28]
Sekitar tahun 1985, Steven Chu dkk. di Bell Labs mengembangkan sebuah teknik untuk menurunkan temperatur atom menggunakan laser. Pada tahun yang sama, sekelompok ilmuwan yang diketuai oleh William D. Phillips berhasil memerangkap atom natrium dalam perangkap magnet. Claude Cohen-Tannoudjimikrokelvin. Hal ini mengijinkan ilmuwan mempelajari atom dengan presisi yang sangat tinggi, yang pada akhirnya membawa para ilmuwan menemukan kondensasi Bose-Einstein.[29] kemudian menggabungkan kedua teknik tersebut untuk mendinginkan sejumlah kecil atom sampai beberapa
Dalam sejarahnya, sebuah atom tunggal sangatlah kecil untuk digunakan dalam aplikasi ilmiah. Namun baru-baru ini, berbagai peranti yang menggunakan sebuah atom tunggal logam yang dihubungkan dengan ligan-ligan organik (transistor elektron tunggal) telah dibuat.[30] Berbagai penelitian telah dilakukan untuk memerangkap dan memperlambat laju atom menggunakan pendinginan laser untuk mendapatkan pemahaman yang lebih baik mengenai sifat-sifat atom.[31]
Komponen-komponen atom
Partikel subatom
Walaupun awalnya kata atom berarti suatu partikel yang tidak dapat dipotong-potong lagi menjadi partikel yang lebih kecil, dalam terminologi ilmu pengetahuan modern, atom tersusun atas berbagai partikel subatom. Partikel-partikel penyusun atom ini adalah elektron, proton, dan neutron. Namun hidrogen-1 tidak mempunyai neutron. Demikian pula halnya pada ion hidrogen positif H+.
Dari kesemua partikel subatom ini, elektron adalah yang paling ringan, dengan massa elektron sebesar 9,11 × 10−31 kg dan mempunyai muatan negatif. Ukuran elektron sangatlah kecil sedemikiannya tiada teknik pengukuran yang dapat digunakan untuk mengukur ukurannya.[32] Proton memiliki muatan positif dan massa 1.836 kali lebih berat daripada elektron (1,6726 × 10−27 kg). Neutron tidak bermuatan listrik dan bermassa bebas 1.839 kali massa elektron[33] atau (1,6929 × 10−27 kg).
Dalam model standar fisika, baik proton dan neutron terdiri dari partikel elementer yang disebut kuark. Kuark termasuk kedalam golongan partikel fermion dan merupakan salah satu dari dua bahan penyusun materi dasar (yang lainnya adalah lepton). Terdapat enam jenis kuark dan tiap-tiap kuark tersebut memiliki muatan listri fraksional sebesar +2/3 ataupun −1/3. Proton terdiri dari dua kuark naik dan satu kuark turun, manakala neutron terdiri dari satu kuark naik dan dua kuark turun. Perbedaan komposisi kuark ini mempengaruhi perbedaan massa dan muatan antara dua partikel tersebut. Kuark terikat bersama oleh gaya nuklir kuat yang diperantarai oleh gluon. Gluon adalah anggota dari boson tolok yang merupakan perantara gaya-gaya fisika.[34][35]
Inti atom
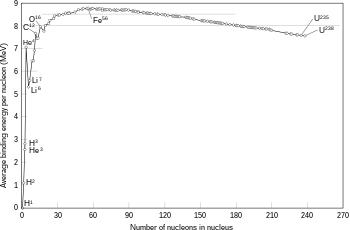
Energi pengikatan yang diperlukan oleh nukleon untuk lolos dari inti pada berbagai isotop.
Inti atom terdiri atas proton dan neutron yang terikat bersama pada pusat atom. Secara kolektif, proton dan neutron tersebut disebut sebagai nukleon (partikel penyusun inti). Diameter inti atom berkisar antara 10-15-14m.[36] Jari-jari inti diperkirakan sama dengan ![\begin{smallmatrix}1,07 \sqrt[3]{A}\end{smallmatrix}](http://upload.wikimedia.org/math/b/5/6/b56e16e37f6036d3414eaf3c1d299f8a.png) fm, dengan A adalah jumlah nukleon.[37]gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38] hingga 10 Hal ini sangatlah kecil dibandingkan dengan jari-jari atom. Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik potensial yang disebut
fm, dengan A adalah jumlah nukleon.[37]gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38] hingga 10 Hal ini sangatlah kecil dibandingkan dengan jari-jari atom. Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik potensial yang disebut
![\begin{smallmatrix}1,07 \sqrt[3]{A}\end{smallmatrix}](http://upload.wikimedia.org/math/b/5/6/b56e16e37f6036d3414eaf3c1d299f8a.png) fm, dengan A adalah jumlah nukleon.[37]gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38] hingga 10 Hal ini sangatlah kecil dibandingkan dengan jari-jari atom. Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik potensial yang disebut
fm, dengan A adalah jumlah nukleon.[37]gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38] hingga 10 Hal ini sangatlah kecil dibandingkan dengan jari-jari atom. Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik potensial yang disebut
Atom dari unsur kimia yang sama memiliki jumlah proton yang sama, disebut nomor atom. Suatu unsur dapat memiliki jumlah neutron yang bervariasi. Variasi ini disebut sebagai isotop. Jumlah proton dan neutron suatu atom akan menentukan nuklida atom tersebut, sedangkan jumlah neutron relatif terhadap jumlah proton akan menentukan stabilitas inti atom, dengan isotop unsur tertentu akan menjalankan peluruhan radioaktif.[39]
Neutron dan proton adalah dua jenis fermion yang berbeda. Asas pengecualian Pauli melarang adanya keberadaan fermion yang identik (seperti misalnya proton berganda) menduduki suatu keadaan fisik kuantum yang sama pada waktu yang sama. Oleh karena itu, setiap proton dalam inti atom harusnya menduduki keadaan kuantum yang berbeda dengan aras energinya masing-masing. Asas Pauli ini juga berlaku untuk neutron. Pelarangan ini tidak berlaku bagi proton dan neutron yang menduduki keadaan kuantum yang sama.[40]
Untuk atom dengan nomor atom yang rendah, inti atom yang memiliki jumlah proton lebih banyak daripada neutron berpotensi jatuh ke keadaan energi yang lebih rendah melalui peluruhan radioaktif yang menyebabkan jumlah proton dan neutron seimbang. Oleh karena itu, atom dengan jumlah proton dan neutron yang berimbang lebih stabil dan cenderung tidak meluruh. Namun, dengan meningkatnya nomor atom, gaya tolak-menolak antar proton membuat inti atom memerlukan proporsi neutron yang lebih tinggi lagi untuk menjaga stabilitasnya. Pada inti yang paling berat, rasio neutron per proton yang diperlukan untuk menjaga stabilitasnya akan meningkat menjadi 1,5.[40]
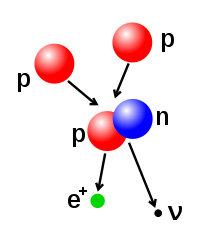
Gambaran proses fusi nuklir yang menghasilkan inti deuterium (terdiri dari satu proton dan satu neutron). Satu positron (e+) dipancarkan bersamaan dengan neutrino elektron.
Jumlah proton dan neutron pada inti atom dapat diubah, walaupun hal ini memerlukan energi yang sangat tinggi oleh karena gaya atraksinya yang kuat. Fusi nuklir terjadi ketika banyak partikel atom bergabung membentuk inti yang lebih berat. Sebagai contoh, pada inti Matahari, proton memerlukan energi sekitar 3–10 keV untuk mengatasi gaya tolak-menolak antar sesamanya dan bergabung menjadi satu inti.[41] Fisi nuklir[42][43] merupakan kebalikan dari proses fusi. Pada fisi nuklir, inti dipecah menjadi dua inti yang lebih kecil. Hal ini biasanya terjadi melalui peluruhan radioaktif. Inti atom juga dapat diubah melalui penembakan partikel subatom berenergi tinggi. Apabila hal ini mengubah jumlah proton dalam inti, atom tersebut akan berubah unsurnya.
Jika massa inti setelah terjadinya reaksi fusi lebih kecil daripada jumlah massa partikel awal penyusunnya, maka perbedaan ini disebabkan oleh pelepasan pancaran energi (misalnya sinar gamma), sebagaimana yang ditemukan pada rumus kesetaraan massa-energi Einstein, E = mc2, dengan m adalah massa yang hilang dan ckecepatan cahaya. Defisit ini merupakan bagian dari energi pengikatan inti yang baru.[44] adalah
Fusi dua inti yang menghasilkan inti yang lebih besar dengan nomor atom lebih rendah daripada besi dan nikeleksotermik, yang berarti bahwa proses ini melepaskan energi.[45] Adalah proses pelepasan energi inilah yang membuat fusi nuklir pada bintang dapat dipertahankan. Untuk inti yang lebih berat, energi pengikatan per nukleon dalam inti mulai menurun. Ini berarti bahwa proses fusi akan bersifat endotermik.[40] (jumlah total nukleon sama dengan 60) biasanya bersifat
Awan elektron
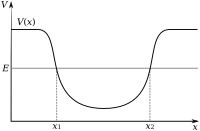
Sumur potensial yang menunjukkan energi minimum V(x) yang diperlukan untuk mencapai tiap-tiap posisi x. Suatu partikel dengan energi Ex1 dan x2. dibatasi pada kisaran posisi antara
Elektron dalam suatu atom ditarik oleh proton dalam inti atom melalui gaya elektromagnetik. Gaya ini mengikat elektron dalam sumur potensi elektrostatik di sekitar inti. Hal ini berarti bahwa energi luar diperlukan agar elektron dapat lolos dari atom. Semakin dekat suatu elektron dalam inti, semakin besar gaya atraksinya, sehingga elektron yang berada dekat dengan pusat sumur potensi memerlukan energi yang lebih besar untuk lolos.
Elektron, sama seperti partikel lainnya, memiliki sifat seperti partikel maupun seperti gelombang (dualisme gelombang-partikel). Awan elektron adalah suatu daerah dalam sumur potensi di mana tiap-tiap elektron menghasilkan sejenis gelombang diam (yaitu gelombang yang tidak bergerak relatif terhadap inti) tiga dimensi. Perilaku ini ditentukan oleh orbital atom, yakni suatu fungsi matematika yang menghitung probabilitas suatu elektron akan muncul pada suatu lokasi tertentu ketika posisinya diukur.[46] Hanya akan ada satu himpunan orbital tertentu yang berada disekitar inti, karena pola-pola gelombang lainnya akan dengan cepat meluruh menjadi bentuk yang lebih stabil.[47]

Fungsi gelombang dari lima orbital atom pertama. Tiga orbital 2p memperlihatkan satu biidang simpul.
Tiap-tiap orbital atom berkoresponden terhadap aras energi elektron tertentu. Elektron dapat berubah keadaannya ke aras energi yang lebih tinggi dengan menyerap sebuah foton. Selain dapat naik menuju aras energi yang lebih tinggi, suatu elektron dapat pula turun ke keadaan energi yang lebih rendah dengan memancarkan energi yang berlebih sebagai foton.[47]
Energi yang diperlukan untuk melepaskan ataupun menambah satu elektron (energi pengikatan elektron) adalah lebih kecil daripada energi pengikatan nukleon. Sebagai contohnya, hanya diperlukan 13,6 eV untuk melepaskan elektron dari atom hidrogen.[48] Bandingkan dengan energi sebesar 2,3 MeV yang diperlukan untuk memecah inti deuterium.[49] Atom bermuatan listrik netral oleh karena jumlah proton dan elektronnya yang sama. Atom yang kekurangan ataupun kelebihan elektron disebut sebagai ion. Elektron yang terletak paling luar dari inti dapat ditransfer ataupun dibagi ke atom terdekat lainnya. Dengan cara inilah, atom dapat saling berikatan membentuk molekul.[50]
Sifat-sifat
Sifat-sifat nuklir
Berdasarkan definisi, dua atom dengan jumlah proton yang identik dalam intinya termasuk ke dalam unsur kimia yang sama. Atom dengan jumlah proton sama namun dengan jumlah neutron berbeda adalah dua isotop berbeda dari satu unsur yang sama. Sebagai contohnya, semua hidrogen memiliki satu proton, namun terdapat satu isotop hidrogen yang tidak memiliki neutron (hidrogen-1), satu isotop yang memiliki satu neutron (deuterium), dua neutron (tritium), dll. Hidrogen-1 adalah bentuk isotop hidrogen yang paling umum. Kadang-kadang ia disebut sebagai protium.[51] Semua isotop unsur yang bernomor atom lebih besar daripada 82 bersifat radioaktif.[52][53]
Dari sekitar 339 nuklida yang terbentuk secara alami di Bumi, 269 di antaranya belum pernah terpantau meluruh.[54] Pada unsur kimia, 80 dari unsur yang diketahui memiliki satu atau lebih isotop stabil. Unsur 43, 63, dan semua unsur lebih tinggi dari 83 tidak memiliki isotop stabil. Dua puluh tujuh unsur hanya memiliki satu isotop stabil, manakala jumlah isotop stabil yang paling banyak terpantau pada unsur timah dengan 10 jenis isotop stabil.[55]
Massa
Karena mayoritas massa atom berasal dari proton dan neutron, jumlah keseluruhan partikel ini dalam atom disebut sebagai nomor massa. Massa atom pada keadaan diam sering diekspresikan menggunakan satuan massa atom (u) yang juga disebut dalton (Da). Satuan ini didefinisikan sebagai seperduabelas massa atom karbon-12 netral, yang kira-kira sebesar 1,66 × 10−27 kg.[56] Hidrogen-1 yang merupakan isotop teringan hidrogen memiliki bobot atom 1,007825 u.[57] Atom memiliki massa yang kira-kira sama dengan nomor massanya dikalikan satuan massa atom.[58] Atom stabil yang paling berat adalah timbal-208,[52] dengan massa sebesar 207,9766521 u.[59]
Para kimiawan biasanya menggunakan satuan mol untuk menyatakan jumlah atom. Satu mol didefinisikan sebagai jumlah atom yang terdapat pada 12 gram persis karbon-12. Jumlah ini adalah sekitar 6,022 × 1023, yang dikenal pula dengan nama tetapan Avogadro. Dengan demikian suatu unsur dengan massa atom 1 u akan memiliki satu mol atom yang bermassa 0,001 kg. Sebagai contohnya, Karbon memiliki massa atom 12 u, sehingga satu mol karbon atom memiliki massa 0,012 kg.[56]
Ukuran
Atom tidak memiliki batasan luar yang jelas, sehingga dimensi atom biasanya dideskripsikan sebagai jarak antara dua inti atom ketika dua atom bergabung bersama dalam ikatan kimia. Jari-jari ini bervariasi tergantung pada jenis atom, jenis ikatan yang terlibat, jumlah atom di sekitarnya, dan spin atom.[60] Pada tabel periodik[61] Oleh karena itu, atom yang terkecil adalah helium dengan jari-jari 32 pm, manakala yang terbesar adalah sesium dengan jari-jari 225 pm.[62] Dimensi ini ribuan kali lebih kecil daripada gelombang cahayanm), sehingga atom tidak dapat dilihat menggunakan mikroskop optik biasa. Namun, atom dapat dipantau menggunakan mikroskop gaya atom. unsur-unsur, jari-jari atom akan cenderung meningkat seiring dengan meningkatnya periode (atas ke bawah). Sebaliknya jari-jari atom akan cenderung meningkat seiring dengan menurunnya nomor golongan (kanan ke kiri). (400–700
Ukuran atom sangatlah kecil, sedemikian kecilnya lebar satu helai rambut dapat menampung sekitar 1 juta atom karbon.[63] Satu tetes air pula mengandung sekitar 2 × 1021 atom oksigen.[64] Intan satu karat dengan massa 2 × 10-4 kg mengandung sekitar 1022 atom karbon.[catatan 2] Jika sebuah apel diperbesar sampai seukuran besarnya Bumi, maka atom dalam apel tersebut akan terlihat sebesar ukuran apel awal tersebut.[65]
Peluruhan radioaktif

Diagram ini menunjukkan waktu paruh (T½) beberapa isotop dengan jumlah proton Z dan jumlah proton N (dalam satuan detik).
Setiap unsur mempunyai satu atau lebih isotop berinti tak stabil yang akan mengalami peluruhan radioaktif, menyebabkan inti melepaskan partikel ataupun radiasi elektromagnetik. Radioaktivitas dapat terjadi ketika jari-jari inti sangat besar dibandingkan dengan jari-jari gaya kuat (hanya bekerja pada jarak sekitar 1 fm).[66]
Bentuk-bentuk peluruhan radioaktif yang paling umum adalah:[67][68]
- Peluruhan alfa, terjadi ketika suatu inti memancarkan partikel alfa (inti helium yang terdiri dari dua proton dan dua neutron). Hasil peluruhan ini adalah unsur baru dengan nomor atom yang lebih kecil.
- Peluruhan beta, diatur oleh gaya lemah, dan dihasilkan oleh transformasi neutron menjadi proton, ataupun proton menjadi neutron. Transformasi neutron menjadi proton akan diikuti oleh emisi satu elektron dan satu antineutrino, manakala transformasi proton menjadi neutron diikuti oleh emisi satu positron dan satu neutrino. Emisi elektron ataupun emisi positron disebut sebagai partikel beta. Peluruhan beta dapat meningkatkan maupun menurunkan nomor atom inti sebesar satu.
- Peluruhan gama, dihasilkan oleh perubahan pada aras energi inti ke keadaan yang lebih rendah, menyebabkan emisi radiasi elektromagnetik. Hal ini dapat terjadi setelah emisi partikel alfa ataupun beta dari peluruhan radioaktif.
Jenis-jenis peluruhan radioaktif lainnya yang lebih jarang meliputi pelepasan neutron dan proton dari inti, emisi lebih dari satu partikel beta, ataupun peluruhan yang mengakibatkan produksi elektron berkecepatan tinggi yang bukan sinar beta, dan produksi foton berenergi tinggi yang bukan sinar gama
Tiap-tiap isotop radioaktif mempunyai karakteristik periode waktu peluruhan (waktu paruh) yang merupakan lamanya waktu yang diperlukan oleh setengah jumlah sampel untuk meluruh habis. Proses peluruhan bersifat eksponensial, sehingga setelah dua waktu paruh, hanya akan tersisa 25% isotop.[66]
Momen magnetik
Setiap partikel elementer mempunyai sifat mekanika kuantum intrinsik yang dikenal dengan nama spin. Spin beranalogi dengan momentum sudut suatu objek yang berputar pada pusat massanya, walaupun secara kaku partikel tidaklah berperilaku seperti ini. Spin diukur dalam satuan tetapan Planck tereduksi (ħ), dengan elektron, proton, dan neutron semuanya memiliki spin ½ ħ, atau "spin-½". Dalam atom, elektron yang bergerak di sekitar inti atom selain memiliki spin juga memiliki momentum sudut orbital, manakala inti atom memiliki momentum sudut pula oleh karena spin nuklirnya sendiri.[69]
Medan magnet yang dihasilkan oleh suatu atom (disebut momen magnetik) ditentukan oleh kombinasi berbagai macam momentum sudut ini. Namun, kontribusi yang terbesar tetap berasal dari spin. Oleh karena elektron mematuhi asas pengecualian Pauli, yakni tiada dua elektron yang dapat ditemukan pada keadaan kuantum yang sama, pasangan elektron yang terikat satu sama lainnya memiliki spin yang berlawanan, dengan satu berspin naik, dan yang satunya lagi berspin turun. Kedua spin yang berlawanan ini akan saling menetralkan, sehingga momen dipol magnetik totalnya menjadi nol pada beberapa atom berjumlah elektron genap.[70]
Pada atom berelektron ganjil seperti besi, adanya keberadaan elektron yang tak berpasangan menyebabkan atom tersebut bersifat feromagnetik. Orbital-orbital atom di sekeliling atom tersebut saling bertumpang tindih dan penurunan keadaan energi dicapai ketika spin elektron yang tak berpasangan tersusun saling berjajar. Proses ini disebut sebagai interaksi pertukaran. Ketika momen magnetik atom feromagnetik tersusun berjajaran, bahan yang tersusun oleh atom ini dapat menghasilkan medan makroskopis yang dapat dideteksi. Bahan-bahan yang bersifat paramagnetik memiliki atom dengan momen magnetik yang tersusun acak, sehingga tiada medan magnet yang dihasilkan. Namun, momen magnetik tiap-tiap atom individu tersebut akan tersusun berjajar ketika diberikan medan magnet.[70][71]
Inti atom juga dapat memiliki spin. Biasanya spin inti tersusun secara acak oleh karena kesetimbangan termal. Namun, untuk unsur-unsur tertentu (seperti xenon-129), adalah mungkin untuk memolarisasi keadaan spin nuklir secara signifikan sehingga spin-spin tersebut tersusun berjajar dengan arah yang sama. Kondisi ini disebut sebagai hiperpolarisasi. Fenomena ini memiliki aplikasi yang penting dalam pencitraan resonansi magnetik.[72][73]
Aras-aras energi
Ketika suatu elektron terikat pada sebuah atom, ia memiliki energi potensial yang berbanding terbalik terhadap jarak elektron terhadap inti. Hal ini diukur oleh besarnya energi yang diperlukan untuk melepaskan elektron dari atom dan biasanya diekspresikan dengan satuan elektronvolt (eV). Dalam model mekanika kuantum, elektron-elektron yang terikat hanya dapat menduduki satu set keadaan yang berpusat pada inti, dan tiap-tiap keadaan berkorespondensi terhadap aras energi tertentu. Keadaan energi terendah suatu elektron yang terikat disebut sebagai keadaan dasar, manakala keadaan energi yang lebih tinggi disebut sebagai keadaan tereksitasi.[74]
Agar suatu elektron dapat meloncat dari satu keadaan ke keadaan lainnya, ia haruslah menyerap ataupun memancarkan foton pada energi yang sesuai dengan perbedaan energi potensial antar dua aras tersebut. Energi foton yang dipancarkan adalah sebanding dengan frekuensinya.[75] Tiap-tiap unsur memiliki spektrum karakteristiknya masing-masing. Hal ini bergantung pada muatan inti, subkelopak yang terisi dengan elektron, interaksi elektromagnetik antar elektron, dan faktor-faktor lainnya.[76]

Contoh garis absorpsi spektrum.
Ketika suatu spektrum energi yang berkelanjutan dipancarkan melalui suatu gas ataupun plasma, beberapa foton diserap oleh atom, menyebabkan elektron berpindah aras energi. Elektron yang tereksitasi akan secara spontan memancarkan energi ini sebagai foton dan jatuh kembali ke aras energi yang lebih rendah. Oleh karena itu, atom berperilaku seperti bahan penyaring yang akan membentuk sederetan pita absorpsi. Pengukuran spektroskopi terhadap kekuatan dan lebar pita spektrum mengijinkan penentuan komposisi dan sifat-sifat fisika suatu zat.[77]
Pemantauan cermat pada garis-garis spektrum menunjukkan bahwa beberapa memperlihatkan adanya pemisahan halus. Hal ini terjadi karena kopling spin-orbit yang merupakan interaksi antara spin dengan gerak elektron terluar.[78] Ketika suatu atom berada dalam medan magnet eksternal, garis-garis spektrum terpisah menjadi tiga atau lebih komponen. Hal ini disebut sebagai efek Zeeman. Efek Zeeman disebabkan oleh interaksi medan magnet dengan momen magnetik atom dan elektronnya. Beberapa atom dapat memiliki banyak konfigurasi elektron dengan aras energi yang sama, sehingga akan tampak sebagai satu garis spektrum. Interaksi medan magnet dengan atom akan menggeser konfigurasi-konfigurasi elektron menuju aras energi yang sedikit berbeda, menyebabkan garis spektrum berganda.[79] Keberadaan medan listrik eksternal dapat menyebabkan pemisahan dan pergeseran garis spektrum dengan mengubah aras energi elektron. Fenomena ini disebut sebagai efek Stark.[80]
Valensi dan perilaku ikatan
Kelopak atau kulit elektron terluar suatu atom dalam keadaan yang tak terkombinasi disebut sebagai kelopak valensi dan elektron dalam kelopak tersebut disebut elektron valensi. Jumlah elektron valensi menentukan perilaku ikatan atom tersebut dengan atom lainnya. Atom cenderung bereaksi dengan satu sama lainnya melalui pengisian (ataupun pengosongan) elektron valensi terluar atom.[81] Ikatan kimia dapat dilihat sebagai transfer elektron dari satu atom ke atom lainnya, seperti yang terpantau pada natrium klorida dan garam-garam ionik lainnya. Namun, banyak pula unsur yang menunjukkan perilaku valensi berganda, atau kecenderungan membagi elektron dengan jumlah yang berbeda pada senyawa yang berbeda. Sehingga, ikatan kimia antara unsur-unsur ini cenderung berupa pembagian elektron daripada transfer elektron. Contohnya meliputi unsur karbon dalam senyawa organik.[82]
Unsur-unsur kimia sering ditampilkan dalam tabel periodik yang menampilkan sifat-sifat kimia suatu unsur yang berpola. Unsur-unsur dengan jumlah elektron valensi yang sama dikelompokkan secara vertikel (disebut golongan). Unsur-unsur pada bagian terkanan tabel memiliki kelopak terluarnya terisi penuh, menyebabkan unsur-unsur tersebut cenderung bersifat inert (gas mulia).[83][84]
Keadaan

Gambaran pembentukan kondensat Bose-Einstein.
Sejumlah atom ditemukan dalam keadaan materi yang berbeda-beda tergantung pada kondisi fisik benda, yakni suhu dan tekanan. Dengan mengubah kondisi tersebut, materi dapat berubah-ubah menjadi bentuk padat, cair, gas, dan plasma.[85] Dalam tiap-tiap keadaan tersebut pula materi dapat memiliki berbagai fase. Sebagai contohnya pada karbon padat, ia dapat berupa grafit maupun intan.[86]
Pada suhu mendekati nol mutlak, atom dapat membentuk kondensat Bose-Einstein, di mana efek-efek mekanika kuantum yang biasanya hanya terpantau pada skala atom terpantau secara makroskopis.[87][88]lewat-dinginkan ini berperilaku seperti satu atom super.[89] Kumpulan atom-atom yang di
Identifikasi

Citra mikroskop penerowongan payaranemas (100). yang menunjukkan atom-atom individu pada permukaan
Mikroskop penerowongan payaran (scanning tunneling microscope) adalah suatu mikroskop yang digunakan untuk melihat permukaan suatu benda pada tingkat atom. Alat ini menggunakan fenomena penerowongan kuantum yang mengijinkan partikel-partikel menembus sawar yang biasanya tidak dapat dilewati.
Sebuah atom dapat diionisasi dengan melepaskan satu elektronnya. Muatan yang ada menyebabkan trayektori atom melengkung ketika ia melalui sebuah medan magnet. Jari-jari trayektori ion tersebut ditentukan oleh massa atom. Spektrometer massa menggunakan prinsip ini untuk menghitung rasio massa terhadap muatan ion. Apabila sampel tersebut mengandung sejumlah isotop, spektrometer massa dapat menentukan proporsi tiap-tiap isotop dengan mengukur intensitas berkas ion yang berbeda. Teknik untuk menguapkan atom meliputi spektroskopi emisi atomik plasma gandeng induktif (inductively coupled plasma atomic emission spectroscopy) dan spektrometri massa plasma gandeng induktif (inductively coupled plasma mass spectrometry), keduanya menggunakan plasma untuk menguapkan sampel analisis.[90]
Metode lainnya yang lebih selektif adalah spektroskopi pelepasan energi elektron (electron energy loss spectroscopy), yang mengukur pelepasan energi berkas elektron dalam suatu mikroskop elektron transmisispektrometri massa waktu lintas.[91] ketika ia berinteraksi dengan sampel. Tomografi kuar atom memiliki resolusi sub-nanometer dalam 3-D dan dapat secara kimiawi mengidentifikasi atom-atom individu menggunakan
Spektrum keadaan tereksitasi dapat digunakan untuk menganalisa komposisi atom bintang yang jauh. Panjang gelombang cahaya tertentu yang dipancarkan oleh bintang dapat dipisahkan dan dicocokkan dengan transisi terkuantisasi atom gas bebas. Warna bintang kemudian dapat direplikasi menggunakan lampu lucutan gas[92] Helium pada Matahari ditemukan dengan menggunakan cara ini 23 tahun sebelum ia ditemukan di Bumi.[93] yang mengandung unsur yang sama.
Asal usul dan kondisi sekarang
Atom menduduki sekitar 4% densitas energi total yang ada dalam alam semesta terpantau, dengan densitas rata-rata sekitar 0,25 atom/m3.[94] Dalam galaksi Bima Sakti, atom memiliki konsentrasi yang lebih tinggi, dengan densitas materi dalam medium antarbintang berkisar antara 105 sampai dengan 109 atom/m3.[95]Gelembung Lokal, yaitu suatu daerah yang mengandung banyak gas ion, sehingga densitas di sekelilingnya adalah sekitar 103 atom/m3.[96] Bintang membentuk awan-awan padat dalam medium antarbintang, dan proses evolusioner bintang akan menyebabkan peningkatan kandungan unsur yang lebih berat daripada hidrogen dan helium dalam medium antarbintang. Sampai dengan 95% atom Bima Sakti terkonsentrasi dalam bintang-bintang, dan massa total atom ini membentuk sekitar 10% massa galaksi.[97] Massa sisanya adalah materi gelap yang tidak diketahui dengan jelas.[98] Matahari sendiri dipercayai berada dalam
Nukleosintesis
Proton dan elektron yang stabil muncul satu detik setelah kejadian Dentuman Besar. Dalam masa waktu tiga menit sesudahnya, nukleosintesis Dentuman Besar kebanyakan menghasilkan helium, litium, dan deuterium, dan mungkin juga beberapa berilium dan boron.[99][100][101] Atom pertama (dengan elektron yang terikat dengannya) secara teoritis tercipta 380.000 tahun sesudah Dentuman Besar, yaitu ketika alam semesta yang mengembang cukup dingin untuk mengijinkan elektron-elektron terikat pada inti atom.[102] Sejak saat itulah, inti atom mulai bergabung dalam bintang-bintang melalui proses fusi nuklir dan menghasilkan unsur-unsur yang lebih berat sampai dengan besi.[103]
Isotop seperti litium-6 dihasilkan di ruang angkasa melalui spalasi sinar kosmis.[104] Hal ini terjadi ketika sebuah proton berenergi tinggi menumbuk inti atom, menyebabkan sejumlah besar nukleon berhamburan. Unsur yang lebih berat daripada besi dihasilkan di supernova melalui proses r dan di bintang-bintang AGBproses s. Kedua-duanya melibatkan penangkapan neutron oleh inti atom.[105] Unsur-unsur seperti timbal kebanyakan dibentuk melalui peluruhan radioaktif unsur-unsur lain yang lebih berat.[106] melalui
Bumi
Kebanyakan atom yang menyusun Bumi dan termasuk pula seluruh makhluk hidupnya pernah berada dalam bentuk yang sekarang di nebula yang runtuh dari awan molekul dan membentuk Tata Surya. Sisanya merupakan akibat dari peluruhan radioaktif dan proporsinya dapat digunakan untuk menentukan usia Bumipenanggalan radiometrik.[107][108] Kebanyakan helium dalam kerak Bumi merupakan produk peluruhan alfa.[109] melalui
Terdapat sekelumit atom di Bumi yang pada awal pembentukannya tidak ada dan juga bukan merupakan akibat dari peluruhan radioaktif. Karbon-14 secara berkesinambungan dihasilkan oleh sinar kosmik di atmosfer.[110] Beberapa atom di Bumi secara buatan dihasilkan oleh reaktor ataupun senjata nuklir.[111][112]Unsur-unsur transuranium yang bernomor atom lebih besar daripada 92, hanya plutonium dan neptunium sajalah yang terdapat di Bumi secara alami.Unsur-unsur transuranium memiliki waktu paruh radioaktif yang lebih pendek daripada umur Bumi, sehingga unsur-unsur ini telah lama meluruh. Pengecualian terdapat pada plutonium-244 yang kemungkinan tersimpan dalam debu kosmik.[107][116] Dari semua Kandungan alami plutonium dan neptunium dihasilkan dari penangkapan neutron dalam bijih uranium.
Bumi mengandung sekitar 1,33 × 1050 atom. Pada atmosfer planet, terdapat sejumlah kecil atom gas mulia seperti argon dan neon. Sisa 99% atom pada atmosfer bumi terikat dalam bentuk molekul, misalnya karbon dioksida, oksigen diatomik, dan nitrogen diatomik. Pada permukaan Bumi, atom-atom saling berikatan membentuk berbagai macam senyawa, meliputi air, garam, silikat, dan oksida. Atom juga dapat bergabung membentuk bahan-bahan yang tidak terdiri dari molekul, contohnya kristal dan logam padat ataupun cair.
Bentuk teoritis dan bentuk langka
 Pencitraan 3-Dimensi keberadaan "Pulau stabilitas" di bagian paling kanan
Pencitraan 3-Dimensi keberadaan "Pulau stabilitas" di bagian paling kanan
Manakala isotop dengan nomor atom yang lebih tinggi daripada timbal (62) bersifat radioaktif, terdapat suatu "pulau stabilitas" yang diajukan untuk beberapa unsur dengan nomor atom di atas 103. Unsur-unsur super berat ini kemungkinan memiliki inti yang secara relatif stabil terhadap peluruhan radioaktif. Atom super berat yang stabil ini kemungkinan besar adalah unbiheksium, dengan 126 proton 184 neutron.
Tiap-tiap partikel materi memiliki partikel antimaterinya masing-masing dengan muatan listrik yang berlawanan. Sehingga, positron adalah antielektron yang bermuatan positif, dan antiproton adalah proton yang bermuatan negatif, Ketika materi dan antimateri bertemu, keduanya akan saling memusnahkan. Terdapat ketidakseimbangan antara jumlah partikel materi dan antimateri. Ketidakseimbangan ini masih belum dipahami secara menyeluruh, walaupun terdapat teori bariogenesis yang memberikan penjelasan yang memungkinkan. Antimateri tidak pernah ditemukan secara alami.Namun, pada tahun 1996, antihidrogen berhasil disintesis di laboratorium CERN di Jenewa.
Terdapat pula atom-atom langka lainnya yang dibuat dengan menggantikan satu proton, neutron, ataupun elektron dengan partikel lain yang bermuatan sama. Sebagai contoh, elektron dapat digantikan dengan muonatom muon. Jenis atom ini dapat digunakan untuk menguji prediksi fisika. yang lebih berat, membentuk







.jpg)